
Les algocarburants, la promesse énergétique attendue ?
Un TPE de Yoann Launay, Lucas Jousseaume et Elyes Zribi.
( III ) L'algocarburant
Un algocarburant est un biocarburant ; qu'est-ce ? Comment l'obtenir ?
Qu'est-ce qui est le mieux ?
(1) Qu'est-ce qu'un biocarburant ?
(A) Définition du Dictionnaire Larousse
« Carburant tiré de la biomasse (matière première végétale, animale ou issue de déchets) pouvant être utilisé comme additif ou substitué aux carburants pétroliers ». Ces carburants pétroliers sont ceux que nous utilisons chaque jour pour nos transports ; l'essence (SP95, SP98, E10, E85) et le gazole (aussi appelé « diesel»).
(B) 3 générations
Il existe plusieurs générations de biocarburants qui s'appuient sur différents types de biomasse.
La « 1ère génération » de biocarburants utilise comme base des ressources alimentaires telles que ; la canne à sucre, la betterave, les céréales, le colza, le maïs, le tournesol, les arachides, le palmier ou encore le soja. On cherche à en obtenir des sucres ou des huiles. Mais ces ressources sont confiées en quantité limitée à cette industrie car elles servent en priorité à nourrir les populations. Cela représente 5 % des productions sucrières et céréalières en France.
La « 2ème génération » de biocarburants cherche donc à utiliser des ressources non-alimentaires associées à de la biomasse lignocellulosique. Celle-ci regroupe les résidus de plantes et bois non-comestibles, riches en cellulose, hémicellulose et lignine dans leurs parois cellulaires. Ces molécules peuvent être exploitées.
Enfin « la petite nouvelle », la « 3eme génération » de biocarburants, celle des algues, est en marche comme vous le voyez actuellement à nos côtés à travers l'algocarburant.
Voici un schéma qui montre les différents suivis de production en fonction des générations de biocarburants.
En vert, la 3ème génération, en jaune la 2ème et en noire la 1ère. A noter qu'il existe toujours des exceptions au niveau de l'appartenance à une génération notamment au niveaux des oléagineux comme le tournesol mais peu importe.
Il faut aussi distinguer deux filières dans la fabrication d'un biocarburant ; la filière essence et la filière gazole.

(C) Filière Biocarburants Essence
Cette filière permet de produire du bioéthanol, c'est-à-dire de l'éthanol grâce à des produits agricoles ; produits sucriers (betterave) et céréaliers dits amylacés car ils possèdent de l'amidon (blé et maïs) .
Les sucres, déjà présents dans les sucriers et synthétisés à partir des amylacés (hydrolyse), permettent par fermentation d'obtenir un alcool. Il sera ensuite distillé et déshydraté pour donner de l'éthanol, ici du « bioéthanol ».
Aujourd'hui celui-ci est incorporé à hauteur de 5 à 10 % dans notre essence et de 65 à 85 % dans le carburant superéthanol E85 (80 centimes le litre) , utilisé par les véhicules dits « Flex fuel » , qui s'adaptent à un carburant hautement alcoolique.
Pour être plus facilement incorporé, on peut ajouter de l'isobutylène pour former de l'ETBE (éthyl tertio butyl éther).
(D) Filière Biocarburants Gazole
Cette filière s'appuie sur des huiles végétales de plantes dites « oléagineuses » (colza, soja, tournesol…)., ou d'huiles issues de grasses animales , ou enfin d'huile végétales alimentaires récupérées. Elles permettent d'obtenir un biogazole ; l'EMAG (Ester méthylique d'acide gras), soit respectivement ; de l'EMHV (Ester méthylique d'huile végétale), de l'EMHA (Ester méthylique d'huile animale) et de l'EMHU (Ester méthylique d'huile usagée) ; eux peuvent être incorporés à hauteur de 7 % du gazole . Cette synthèse d'esters est possible grâce à la technique de la transestérification, que nous approfondirons plus bas.
Il existe en effet un autre type de biogazole que l'EMAG ; le biogazole de synthèse. On peut l'obtenir par une voie thermochimique surnommée « BtL » ( Biomass to Liquid ), en gazéifiant la biomasse et en utilisant la technique de synthèse « Fischer-Tropsch » qui donne du biogazole. Mais on connaît peut-être mieux l'hydrotraitement ; il s’agit d’une hydrogénation catalytique. On fait réagir l'huile en présence d'hydrogène à 300°C. La réaction d’hydrogénation est suivie
d'un hydrocraquage (craquage des molécules longues). On produit alors des hydrocarbures qui peuvent être incorporés en quantité importante au gazole mais surtout au kérosène. Toutefois une importante quantité d'hydrogène est nécessaire à cette transfomation, et du propane (C3H8) est émit parallèlement.
Schéma des deux filières de biocarburants
On peut constater que même si on considère qu'un biocarburant peut substituer un carburant, aujourd'hui ils ne sont encore qu'incorporés et mineurs en comparaison des proportions de carburants pétroliers associés.
(2) De l'huile au au biocarburant ; L'exemple de la transestérification
(A) Explications
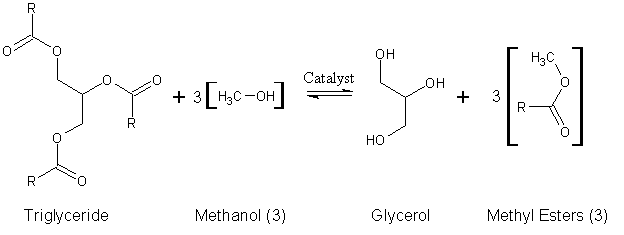
C'est le procédé classique qui permet de transformer une huile en un biodiesel. Elle se caractérise par le mélange d'huile, en l'occurrence pour nous l'huile de nos micro-algues, avec un alcool (l'éthanol ou le méthanol) en présence d'un catalyseur (hydroxyde de potassium ou potassium). On obtient un biodiesel et de la glycérine. La transformation de cette huile en esther éthilique ou méthilique réduit d'un tiers la masse moléculaire de l'huile, mais aussi sa viscosité d'un facteur 8. L'augmentation de la volatilité et la baisse de la densité sont aussi à prévoir. Ces propriétés obtenues sont très similaires à celle d'un diesel classique. Le biodiesel obtenue peut être ajouté au gazole classique à hauteur d'environ 10% du volume.
Cette transformation chimique peut s'écrire sous la formule :
(B) Expérimentation
Cette transformation est donc l'aboutissement de notre tpe et se concrétise par la fabrication d'un biodiesel. Notre quantité d'huile obtenue étant particulièrement faible (3,5 mL), notre tentative de transestérification a échouée. Et de ce fait nous avons décidé de r�éaliser cette transformation à partir d'huile de colza. Voici donc le déroulé de l'expérience...
Tout d'abord nous avons fabriqué une solution de soude alcoolique. Pour cela nous avons mélangé 0,90 d'hydroxyde de sodium en pastille dans 50 mL d'éthanol absolu puis le tout a été chauffé et agité pendant 45 min. Ensuite nous avons introduit 100 mL d'huile de colza avec 50 mL de notre soude alcoolique préalablement réalisée dans un ballon de 250 mL. Le ballon a été placé sur un système de chauffage à reflux avec un système d'agitation magnétique puissant pendant 45 min à nouveau.


Notre montage

Une fois le chauffage terminé, on refroidit le ballon dans un bac d'eau glacée pour gagner du temps et on verse le contenu dans une ampoule à décanter de 250 mL. On mesure le pH de la solution, on remarque qu'il est d'environ 7,5 et donc on ajoute quelques gouttes d'acide chlorhydrique pour que celui-ci avoisine 6.
Aspect du produit pendant le chauffage et l'agitation magnétique
On ajoute aussi de l'eau salée, environ 30mL, pour que le glycérol qui est plus soluble dans l'eau salée se sépare du biodiesel car en effet comme précédemment expliqué cette transformation génère un ester en l’occurrence éthylique pour nous et du glycérol. Ce procédé devrait donc en théorie permettre d'éliminer le glycérol présent dans la solution avec notre ester.

Après agitation

Après ajout de chlorure de sodium (eau salée) (NaCl), agitation avec dégazage et repos, il se forme 2 phases : l'une aqueuse et l'autre organique. On extrait la phase organique supérieure, autrement dit celle qui nous intéresse et on conserve la phase aqueuse pour plus tard.

Notre Hydrodistillation ; voir procédé antérieurement
Nous obtenons donc ce qui pourrait être un biocarburant mais nous décidons de le purifier pour éliminer des substances autres que notre ester présentes dans la phase organique tel que l'éthanol.
Pour cela nous réalisons une hydrodistillation. La température de l'éthanol étant d'environ 80°C, celui-ci devrait s'évaporer et retomber dans l'erlenmeyer et ainsi il nous resterait uniquement notre ester éthylique de colza (EEC). On place un thermomètre pour mesurer la température. Une fois à 80°C, on diminue le chauffage de façon à ce que soit uniquement l'éthanol qui s'évapore.
Après 15 min, on obtient notre biodiesel, celui-ci est liquide et au fond il y a un solide blanc indéterminé. En refroidissant, il se solidifie et devient similaire à de la gelée :

(C) Identification
On décide de mesurer sa densité. Pour cela, on le verse dans une éprouvette graduée et on calcule son volume et sa masse. On reproduit la même manipulation avec l'huile de colza utilisée au tout début qui n'a subie aucune transformation.
Masse volumique EEC = Masse (en g)/Volume (en cm³) = 90,03/99,0 = 0,909g/cm3
Donc densité EEC = 0,909
Masse volumique huile de colza= Masse (en g)/Volume (en cm³) = 91,12/100 = 0,911g/cm3
Donc densité huile de colza = 0,911.
Nous avons donc bien un biodiesel car la densité a diminuée certes mais très peu.

Démonstration de viscosité du produit obtenu
De plus on choisit de mettre en évidence la présence, retrouver, le glycérol qui est l'autre produit de la transestérification car l'identification d'un biocarburant est trop compliquée à réaliser au lycée. Pour cela, on réalisera un test d'identification rapide puis une chromatographie sur couche mince (CCM).
Test d'identification 1 :
On sait que le glycérol en présence d'une solution de soude et d'ions Cu2+, donne un précipité indigo qui se différencie du précipité d'hydroxyde de cuivre II Cu(OH)2 que l'on observe quand on met en contact la solution de soude et la solution contenant les ions Cu2+.
On décide donc d'utiliser 4 tubes à essais pour mettre en évidence sa synthèse (photo ci-dessous) :
-Tube à essai 1 : Il est composé de 1 mL d'eau distillée, de quelques gouttes d'une solution de soude et de quelques gouttes d'une solution de sulfate de cuivre. C'est le tube témoin.
-Tube à essai 2 : Il est composé de 1 mL de notre phase aqueuse que nous avions préalablement récupérée lors de notre décantation puis nous y avons ajouté quelques gouttes d'une solution de soude et quelques gouttes d'une solution de sulfate de cuivre.
-Tube à essai 3 : On répète l'opération avec de l'huile de colza.
-Tube à essai 4 : Pour vérifier si tout le glycérol a été éliminé de notre biocarburant, on reproduit le test avec notre ester après purification.
On agite les tubes.
On observe que le tube 1 et 3 n'ont pas de précipité indigo contrairement au tube à essai 2 et 4. On conclut que notre transestérification a bien eu lieu car en effet il n'y avait pas de glycérol au départ (tube 3) mais qu'il y en a à la fin (tube 2) . Malheureusement, on s'aperçoit aussi qu'il reste du glycérol dans notre biocarburant (tube 4). Il ne sait pas séparé entièrement de notre ester lors de notre chauffage à reflux car celui-ci n'a pas pu s'évaporer lors de notre hydrodistillation due à une température insuffisante (<290°C). Notre biodiesel n'est donc pas constituée uniquement d'EEC.

Test d'identification 2 :
Chromatographie sur couche mince
Tout d'abord on verse dans une cuve 10 mL d'éluant qui est constitué à 90 % de butanol, à 9 % d'eau distillée et à 1 % d'acide acétique glacial. Puis on sature la cuve en vapeur de l'éluant à l'aide d'une bande de papier filtre posée contre la paroi. Ensuite on trace une ligne de dépôt sur une plaque avec gel de silice à 1 cm du bord. On trace 3 points, sur lesquels on dépose avec un capillaire 3 gouttes des solutions suivantes. A : ester purifié. B : produit de synthèse. C : glycérol de référence On met la plaque de façon vertical dans la cuve. - Après 30 min, l'éluant atteint les 2/3 de la plaque, on décide donc de la sortir. On la sèche à l'aide d'un sèche-cheveux. Puis on la trempe dans une solution de permanganate de potassium (KMnO4). Enfin on la pose sur du papier absorbant. (Voir photo ci-dessous) On observe que 2 taches jaunes correspondant au B et C qui sont donc composé de glycérol et on aperçoit le début d'une tache au niveau du A ce qui met à nouveau en évidence le fait qu'il reste encore du glycérol dans notre biodiesel.

Test d'identification 3 :
On réalise un dernier test qui a pour but de mettre en évidence la synthèse de notre biocarburant : un test d'inflammabilité. Pour cela, on verse quelques gouttes de notre biocarburant sur du coton puis on l'enflamme. Celui-ci prend feu instantanément. On réalise la même expérience sans biocarburant et on s'aperçoit que le coton ne s'enflamme pas :
Toutes ces étapes nous ont permises de synthétiser en partie un biodiesel. Le fait qu'il ne soit pas complètement liquide peut être dû à plusieurs facteurs :
- le glycérol présent dans notre biocarburant
- peut être le biocarburant est-il pâteux car dans les stations essences le diesel est chaud et ce n'est qu'en se refroidissant qu'il s'est solidifié.
- ici nous obtenons un biodiesel pur or dans le diesel commercialisé de nombreux additifs sont ajoutés qui pour certains ont peut être pour but de le fusionner.
Mais notre expérience montre combien il est long et difficile de transformer une huile en un biocarburant.
(3) Comparaisons entre les huiles algales, les huiles oléagineuses et vue d'ensemble pour les carburants en général :
Les plantes oléagineuses sont des végétaux terrestres dont le corps est principalement composé de lipides et de protéines, ce qui leur vaut le nom d'oléoprotéagineux. Leurs lipides une fois extraits sont alors sous forme d'huiles dites oléagineuses puis peuvent êtres réutilisés pour constituer des huiles alimentaires, des produits bien-être et santé mais surtout des biodiesels, à la manière des huiles algales, partie déjà abordée antérieurement. Ces biodiesels oléagineux se nomment diester.
(A) Un lien entre micro-algues et oléagineux
Les organismes oléagineux sont, comme dit ci-dessus, principalement composés de lipides. On peut par exemple prendre la graine de colza qui est à 45% composée de lipides. Et bien pour les micro-algues, c'est pareil : les lipides représentent un très gros pourcentage du micro-organisme (allant de 50 à 80% du corps de l'algue en fonction de l'espèce). On voit donc que l'on a affaire à deux organismes végétaux au corps gras très chargés en lipides. On peut donc penser que les potentialités des deux organismes sont similaires.
Voici un tableau mettant en évidence les différents rendements lipidiques de certaines micro-algues

(B) Pourquoi choisir les micro-algues ? Et pas les oléagineux ? Et pas les produits fossiles ?
En effet, si les deux organismes ont la possibilité de former du biocarburant, alors pourquoi choisir la micro-algue et non l'organisme oléagineux ?
La raison est simple : la constitution d'un biocarburant est depuis la création du biodiesel dominé par les oléagineux mais une solution pour le futur serait de remplacer ces oléagineux par des micro-organismes : les algues unicellulaires ou micro-algues. En effet les rendements des algues sont largement plus importants car la proportion de lipides dans leurs corps est beaucoup plus grande que chez les oléagineux. On peut par exemple constater que la moins lipidique des micro-algues possède en proportions plus de lipides que le plus lipidique des oléagineux. En effet les micro-algues produisent à l'hectare 5 à 10 fois plus d'huile lipidique que les palmiers à huile ou que le colza et elles forment en moyenne 30 fois plus d'huile que la moyenne des oléagineux. Nous allons donc observer la production d'huiles de la moins bonne des micro-algues qui est de 15 000 litre par ans. Comparons maintenant ce chiffre à celui que représente les rendements du meilleur des organismes oléagineux qu'est le palmier à huile : on observe seulement 5950 litres d'huile de palme par ans. On obtient donc la preuve que les rendements des micro-algues sont largement supérieurs à ceux des organismes oléagineux. De plus des huiles comme l'huile de palme figent à temperature ambiante, soit 18°C contre une moyenne de 30°C pour une bonne huile algale. C'est le cas du phaelodactylum tricornutum, algue produisant une huile qui se fige a 30°C. Il y a donc aussi une différence dans la qualité de l'huile produite : les micro-algues font une huile plus pratique et en plus grande quantité, on peut donc dire que cela a l'air de se présenter comme une solution pour l'avenir.
A cela s'ajoute le fait suivant : les organismes oléagineux peuvent être affecté par des pesticides, or les micro-algues restent dans un milieu naturel. Cela affecte aussi la qualité des huiles qui seront alors moins pures chez les oléagineux. Les algues unicellulaires se développant sous l'eau, on peut de plus considérer que les cultiver à la place des oléagineux permettrait un gain de place important.
Dans l'industrie du carburant on trouve beaucoup de pétrole, mais on sait aussi que le pétrole est une source d'énergie limitée. En moyenne, une énergie fossile possède un cycle de réalimentation en CO2 qui est de 2 millions d'années. Grâce à la photosynthèse, la micro-algue serait donc une solution pour réduire la pollution par une émission moins importante de gaz à effets de serre et même un cycle ; le biocarburant consommé par nos usages émet du dioxyde de carbone dans l'air, mais la micro-algue incorpore celui-ci à sa biomasse. Un équilibre ?
Tous ces éléments en font donc une source d'énergie exploitable, plus adaptée et qui pourrait régler certains problèmes actuels. Mais alors qu'est ce qui empêche réellement les huiles alguales d'être à la base des carburants d'aujourd'hui ?
