
Les algocarburants, la promesse énergétique attendue ?
Un TPE de Yoann Launay, Lucas Jousseaume et Elyes Zribi.
( II ) Exploiter la micro-algue
(1) Culture artisanale
Dans le cadre de notre TPE, nous avons effectué une visite à l'IFREMER de Nantes (Institut Français de Recherche pour l'Exploitation de la Mer). Cela nous a permis entre autre de comprendre ou découvrir des notions importantes. Cependant ce n'est pas tout, nous avons demandé s'il était possible d'obtenir des échantillons de micro-algues dans le but d'expérimenter. C'est ainsi qu'il nous a été fourni :
- 1,5 L d'une culture de phaelodactylum tricornutum (diatomées) tout juste nourries
- 14 mL de chlorelles à mettre en culture
- 14 mL d'un milieu nutritif appelé milieu de Conway (contenant notamment le silicium)
- 1,5 L d'eau de mer
C'est donc au plus vite que nous avons lancé les expériences. Il faut distinguer les deux espèces. Pour les Phaelodactylum Tricornutum, la culture était déjà bien avancée et nourrie, nous l'avons donc seulement transférée dans un aquarium fermé hermétiquement muni d'un bulleur, pour alimenter en CO2 la culture tout en la protégeant des microbes.
En ce qui concerne les chlorelles (algues vertes), nous avons effectué une mise en culture.
Dans un premier temps, nous avons mis les chlorelles dans un erlenmeyer stérile, en y ajoutant 100 mL d'eau de mer et 0,1 ml du milieu de Conway. Nous avons fermé le tout à l'aide d'un coton pour protéger la culture tout en la laissant « respirer ». Le bulleur n'étant pas encore nécessaire. A T=0 la culture était incolore car la concentration en algues était très faible. Les deux cultures, pour qu'il y ait photosynthèse comme vu précédemment, ont été placés devant une fenêtre, définissant ainsi un cycle lumineux particulier ; à T=0 (en jours), le soleil se levait à 8h21 et se couchait à 19h23, tandis qu'à la fin de l'expérience (T=52) il se levait à 8h35 pour une heure de coucher à 17h17. L'apport de lumière était certes connu mais non contrôlé tout comme la température qui était de 19°C en moyenne.
Voici notre culture de Phaelodactylum juste après l'avoir transférée dans un aquarium.

Nous avons suivi de très près les nombres respectifs de microalgues dans chacune des cultures grâce à des comptages réguliers.
Une lame de kova
Protocole d'un comptage microscopique
Pour commencer on insère une petite goutte à étudier dans une des 10 cupules d'une lame de kova, puis on met la lame sous le microscope. Pour nos cultures un grossissement de 100 était nécessaire ; il suffit ensuite de compter les organismes dans un carré à l’œil nu ou à l'aide d'un logiciel, ce qui a été notre cas avec Mesurim. Dans certains cas la concentration était trop forte pour pouvoir compter ; on effectuait donc une dilution.
9 grand carrés contiennent 1 µL de liquide
1 grand carré (formé de 9 petits carrés) contient 0,1 µL
1 petit carré contient 0.01 µL
Voici quelques captures d'écran montrant l'évolution des concentration. (Il s'agit de petits carrés).


Notre culture de Phaelodactylum à T=3
Notre culture de Phaelodactylum à T=38


Notre culture de chlorelles à T=3
Notre culture de chlorelles à T=38



Transfert
Notre culture de chlorelles (1.115 L ) à T=25
Notre culture de chlorelles (114 mL ) à T=25
Notre culture de chlorelles (1.115 L ) à T=52
A T=25, les chlorelles étaient en nombre suffisant pour les élever à plus grande échelle ; nous les avons ainsi transférées dans un aquarium en y ajoutant 1 L d'eau de mer. Nous avons même pu observer une grande différence de coloration. En effet, les micro-algues se reproduisent vite car elles ont un cycle cellulaire très court (24h en moy).
Avec un total de six séances de comptages, nous avons pu établir une série de données et construire un graphique. Les cases grisées représentent l'insertion du milieu nutritif

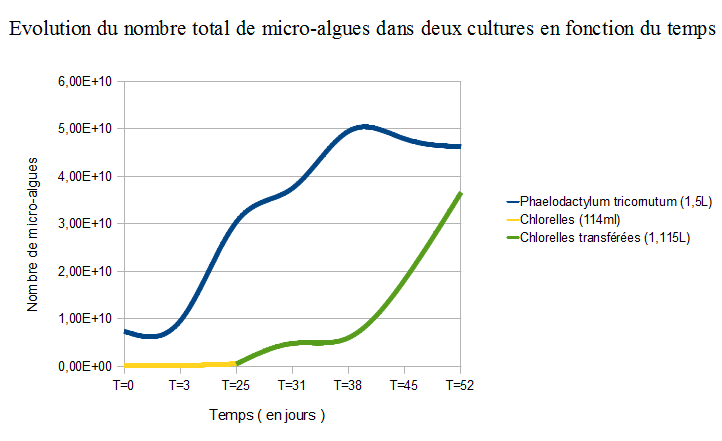
On peut donc voir même à petite échelle, la croissance rapide de ces micro-organismes. (Il faut d'ailleurs noter que les phaelodactylum ont cessé de croître car la culture était saturée.) Chez les micro-algues le rendement photosynthétique est très important. Il s'agit du rapport entre les rayons lumineux et l’énergie que stocke la plante. Le rendement photosynthétique des embryophytes (plantes terrestres) est de 2% environ c'est-à-dire que 2% de l’énergie solaire est stockée sous forme de matière organique. Or les micro-algues ont un rendement photosynthétique qui approche les 10%, ce qui est très proche de la valeur maximale théorique.
La conséquence de cet important rendement est un taux de croissance très élevé : certaines micro-algues peuvent doubler en 4 heures. Cette qualité permet ainsi aux chercheurs de les cultiver dans un cadre de production industrielle à l’échelle mondiale.
(2) Paramètres de culture et optimisation
Voici un film que nous avons réalisé à l'IFREMER de Nantes. Mr.Kaas, Chercheur en océanographie et biologie, nous présente les expériences sur l'optimisation des paramètes de culture.
Durant notre visite à IFREMER, l'institut français de recherches pour l'exploitation de la mer, nous avons aussi appris grâce aux propos de M. Kaas que vous pouvez écouter dans la vidéo ci-jointe que des facteurs appelés paramètres de culture pouvaient influer sur le développement de la micro-algue.
Ainsi, il nous a expliqué que l'influence de ces paramètres variait en fonction de l'organisme en culture et il nous a donc préciser la manière de faire afin de déterminer l'influence de ces facteurs.
Il faut aussi préciser au préalable que les facteurs sont choisis aléatoirement, ils peuvent se traduire par du calcium, de la lumière, une température ou encore tout simplement par le potentiel hydrogène de de la solution contenant ce même organisme.
En résumé, il est simple de déterminer l'influence d'un seul facteur car il suffit juste de le faire varier mais les laboratoires de recherche comme ceux d'IFREMER vont plus loin : ils ont élaboré des expériences afin de déterminer les effets de l’interaction de plusieurs de ces facteurs et l'influence qu'ils auront sur l'organisme en culture. Par exemple, la température peut ne pas influer sur l'effet de l'intensité lumineuse mais il se peut par contre qu'elle agisse avec le pH afin d’inverser la tendance et que la culture se développe tout d'un coup mieux dans un milieu acide à une forte température alors qu'à une faible température le milieu basique était plus intéressant à exploiter. Cela leur permet ainsi d'optimiser au maximum le développement de la culture.
Voici les étapes de l’expérience :
- Pour se faire, ils choisissent tout d'abord le nombre de facteurs à étudier en même temps. Dans la vidéo, l'exemple est donné avec les trois facteurs que sont la température, le pH et l'intensité lumineuse, mais M. Kaas nous a tout de même annoncé que nous pouvions aller au-delà et il nous à donné comme exemple une de ses expériences dans laquelle il étudiait simultanément 13 facteurs différents.
- Ils calculent ensuite par l'utilisation des plans factoriels et d'autres techniques liées aux statistiques le nombre d’expériences minimum afin de pouvoir obtenir des résultats concluants.
-Ils effectuent ensuite leurs expériences puis en tirent des résultats qui leur permettent de développer au mieux leurs organismes en culture.
Une expérience sur l'influence des paramètres de culture de multiples micro-algues était d'ailleurs en cours comme vous pouvez le voir sur la vidéo, et cela permet une meilleure rentabilité au fil du temps car les algues se multiplient plus vite et cela équivaut à avoir plus de matière à exploiter afin de produire du biocarburant.
(3) Echelle industrielle
Pour pallier à la disparition progressive des énergies fossiles, les biocarburants et plus particulièrement les micro-algues sont une des solutions les plus prometteuses. Des centaines d'entreprises autour du globe ont choisi de se lancer dans l'aventure. La production annuelle est estimée à 6000 t par an de matière sèche. Cette culture peut être conduite sous 2 formes : un bassin ouvert à haut rendement : le raceway ou un milieu fermé stérile éclairé par lumière naturelle ou artificielle : les photo-bioréacteurs.
(A) Le Raceway
Le Raceway est un bassin en boucle fermé de quelques dizaines de centimètres de fond. Le système est couplée à une roue à aube qui permet de créer un courant et un bulleur pour un apport de CO2. C'est le système le plus utilisé dans le monde. La taille de ces bassins varie de 0,3 à 0,5 Ha et représente un coût peu élevé d'environ 40 000$/Ha et par an. Certains paramètres sont toutefois incontrôlés comme la température du milieu qui fluctue en fonction de la météo ou la hauteur de la lame d 'eau. Ce système est de plus très sensible au facteurs extérieurs et donc facile à contaminer. C'est pourquoi seul un nombre limité de micro-algues peut y être cultivées tels que les espèces poussant dans les milieux très alcalins, hypersalins ou à pH très bas.

(B) Les Photobioréacteurs
Il s'agit d'un système en culture fermée, que nous avons eu la chance de découvrir lors de notre visite à l'IFREMER de Nantes. Mr Kaas, un des chercheurs de l'IFREMER nous a expliqué le fonctionnement de ces tubes qui apparaissent de différentes couleurs et que tous les tubes ne se valent pas. Rentrons un peu plus dans le détail de ce système très prometteur mais qui présente quelques inconvénients.
C'est donc une association de plusieurs tubes transparents en plastique ou en verre. Il peut être éclairé de façon naturelle ou artificielle. Le diamètre de ces tubes est très important car il ne doit pas être trop épais pour que la lumière puisse le traverser en entier mais suffisamment grand pour pouvoir y stocker un maximum de micro-algues. Les conditions d'un photo-bioréacteur doivent être parfaitement optimisées afin que les besoins du système en énergie soient minimisés. Ce système présente de nombreux avantages, en effet il est hermétique et ne peut donc pas être contaminé, de plus des facteurs comme la lumière, la quantité de CO2 ou la température sont fixés pour que la productivité des micro-algues soit maximale (voir (2) ). Ce système peut donc s'appliquer à un très large choix de micro-algues, toutefois, vu le coût très important nécessaire à son fonctionnement il est réservé seulement aux micro-algues à hautes valeurs ajoutées (grand rendement lipidique). Ce système permet aussi aux micro-algues d'avoir une densité élevée (5 à 10g/L) et donc d'être beaucoup plus rentable mais son coût de maintenance et sa consommation énergétique exorbitante le pénalise énormément, moins d'1% de la production mondiale est cultivée dans ces conditions.


Malgré de nombreuses contraintes (densité cellulaire faible et une productivité correcte mais pas maximale) il présente certains avantages (un coût de production et une consommation énergétique faible). Le rendement du raceway en biomasse n'est donc pas optimal mais avec un coût réduit il reste une des solutions de cultures les plus rentables.
Extrait de notre visite à l'IFREMER de Nantes
Mr. Kaas présentent les photobioréacteurs.
Définitions :
Hypersalins : Un milieu hypersalin est extrêmement salé. Il désigne ainsi des milieux comme les lacs hypersalins avec de l'eau hypersaline. Un lac hypersalin est un plan d'eau enclavé qui contient des concentrations importantes de chlorure de Sodium ou d'autres sels minéraux, dépassant ceux de l'eau de mer (naturellement d'environ 3,5% , soit 35 grammes par litre).
(4) Mutations
(A) Un projet
Afin d’améliorer les rendements en lipides qui pourraient permettre la production de carburant, des instituts comme IFREMER ont eut l’idée d’étudier la mutation chez certaines algues puis de la provoquer. C 'est ainsi qu'est né le projet Facteur 4 pour un coût de 5 600 000 € financé pour une grande partie par l'ANR (687 940 €). Sur ce projet, IFREMER a lié un partenariat avec l'INRIA et l'UPMC, deux des plus grands organismes scientifiques en France à l’heure actuelle.
(B) Fonctionnement
Ce projet avait pour but de multiplier la formation de lipides par 4. Pour cela ils ont procédé à une série de tests sur la chaîne nucléotidique de micro-algues en utilisant la méthode du marquage (le marquage est l'insertion de nucléotides modifiés ou la modification d'un nucléotide déjà présent afin de pouvoir repérer dans la chaîne nucléique les changements associés), ce qui a permit aux scientifiques de déterminer la mutation qui sera la plus intéressante pour eux. Ils ont donc pu decouvrir que les ultaviolets de type C, compris entre 100 et 280 nanométres, rendent les algues plus énergétiques, ce qui leur permettent de former plus de lipides.
(C) Durabilité
C'est ainsi qu'ils ont, à partir de mars 2012 et pour une durée de 36 mois, exploité ces mutations. Il reste cependant des facteurs qui empêchent l'utilisation de ces algues optimisées pour notre quotidien, notamment l'incertitude concernant l'éventuel échange nocif de mutations du végétal a l'homme. La mutation via ultraviolets C par exemple est la cause d'une latence d'environ 1 mois entre deux mitoses et cela pourrait s'avérer problématique si l'Homme se voyait touché par cette mutation. Mais ce projet n'est qu'un exemple, et il se peut que d'autres entreprises ou organismes exploitent ou étudient les mutations chez les organismes unicellulaires que sont les micro-algues.
(5) Vers la production d'une huile
Les grandes entreprises de l'industrie des algocarburants utilisent différentes méthodes afin d'extraire les lipides de leurs cultures. Cependant il existe aussi des méthodes de purification de ces lipides car certaines méthodes d'extraction peuvent les rendre impurs (car contenus dans un solvant). C'est pourquoi certains projets comme SHAMASH regroupent des spécialistes de l'extraction et de la purification.
Nous pouvons au passage expliquer ce qu 'est le projet SHAMASH afin d'améliorer votre compréhension. SHAMASH est donc un projet français qui a regroupé 8 entreprises dans le but de produire du biocarburant de qualité à partir de micro-algues. Il s'agissait d'un grand projet debuté en décembre 2006 pour une durée de 4 ans et qui a demandé financement conéquent s 'élevant a 2,8 millions d'euros.
Voici donc quelques techniques d'extraction très répandues aujourd'hui.
(A) Extraction par solvant
L'extraction par solvant est une méthode basique mais ce n'est pas forcément la plus prisée. Elle consiste à mettre dans un même récipient notre solution contenant les micro-algues et une autre solution non miscible à la première mais dont la miscibilité avec les lipides est plus importante. Cette dernière constitue le solvant. On procède alors à une décantation pour que les lipides migrent dans le solvant en quittant les micro-algues de la culture.
Cette méthode peut, dans son cas, être considerée parmis les moins efficaces. En effet, les lipides ne sont pas à l'état pur ; on doit alors procéder ensuite à une purification grâce à une distillation par exemple, afin d'éliminer le solvant et obtenir une huile. Cependant les micro-algues ne meurent pas au contact d'un solvant tel que l'hexane, elles peuvent donc être remises en culture après extraction. Ce n'est donc pas une méthode sans avantages même si elle entraîne des inconvenients majeurs, d'autant plus qu'elle constitue la moins chère des méthodes.

(B) Extraction au CO2 supercritique
L'une des plus efficaces est l'extraction par fluides supercritiques, apparue vers 1970 et très proche de l'extraction par solvant. Dans le cas des micro-algues, le fluide utilisé est le CO2 supercritique car ses proprietés sont les plus adaptées et que son prix est abordable (1€ le kilogramme). Il s'agit en fait de CO2 auquel on impose une temperature de 31°C et une pression de 73,8 bar. Il se retrouve alors entre l'état gazeux et l'état liquide. Ce fluide ainsi créé est capable d'extraire des molécules organiques comme les lipides à partir des végétaux en agissant tel un solvant. On récupère alors cette molécule en rendant au CO2 un etat gazeux, c'est à dire en le remettant dans un milieu ambiant.

Animation présentant le fonctionnement de l'extraction supercritique. (Vidéo Youtube)

Graphique des diférents états de la matière en fonction de la pression et de la température (image.google.fr)
Cette méthode est rendue efficace notamment par la conservation de la pureté des lipides tout au long de la manipulation, mais aussi par la préservation de la source de lipides que sont les micro-algues.
(C) Extraction par micro-onde
L'extraction par micro-onde est une méthode complexe qui s'allie avec l'hydrodistillation. En effet, l'envoi de micro-ondes dans la solution va faire chauffer l'eau qui la compose, et la modification soudaine de température va modifier tout aussi subitement la pression à l'intérieur de la solution contenant la micro-algue. Ce phénomene soudain va faire éclater la structure des micro-algues et les lipides vont donc être liberés. En chauffant, l'eau et les élements volatils que sont les lipides vont s'évaporer. L'huile et l'eau devrait alors faire deux phases differentes, il ne restera plus qu'à extraire le phase huileuse. De même, on peut envisager l'hydrodistillation en passant par la centrifugation qui éclaterait aussi la structure moléculaire des micro-algues.
Cette méthode est pour sa part un peu moins performante car elle ne permet pas de conserver les micro-algues, mais elle reste cependant une méthode efficace en cas d'extraction unique et non en chaîne.
(D) Expérimentation
Nous avons pour notre part opté pour l'extraction par solvant car elle était avant tout à notre portée. Ainsi nous avons utilisé comme solvant la solution la plus répandue pour l'utilisation de cette méthode à l'échelle industrielle : le cyclohexane.
C'est un produit qui nécessite des précautions telles que la manipulation sous hotte aspirante (voir fiche danger à droite).
Voici nos 2 mélanges de départ dans des ampoules à décanter pour nos 2 cultures différentes :


Notre extraction sur les chlorelles
On peut constater que la phase supérieure de chaque ampoule a légèrement augmenté de quelques millilitres ; cette phase accueille donc bien des lipides. Ce phénomène était particulièrement visible après homogénéisation lorsque des bulles grasses se sont formées, ils s'agissait des lipides (voir vidéo).

Pour vérifier l'obtention de ces lipides, nous avons versé un colorant rouge qui se fixe sur les lipides : le rouge soudan (ou Nile Red). Il n'y a ensuite plus qu'à observer :
Ensuite, nous avons rencontré un problème : certes les lipides n'étaient plus dans les micro-algues mais ils étaient toujours contenus dans le cyclohexane. En effet, comme dit ci-dessus les lipides rencontrent alors une situation d'impureté. C'est pourquoi, après avoir analysé un échantillon, nous avons dû les purifier.
Nous avons choisi une simple distillation, toujours sous hotte afin de séparer les lipides du cyclohexane pour obtenir une huile.
Le cyclohexane a une température d'ébullition fixée à 80° C tandis qu'une huile boue aux alentours de 300° C. C'est donc le solvant qui s'évapore si l'on chauffe à 80°C. Le réfrigérant, en refroidissant, permet de le récupérer sous forme liquide (voir ci-dessous) :
Notre extraction sur les Phaelodactylum



Schéma du montage à distillation
Les lipides se sont ainsi retrouvés isolés et notre extraction était terminée. Nous avons obtenu 3,5 ml d'huile alguale de phaelodactylum, contre le néant avec les chlorelles ; on peut supposer que l'huile s'est dégradée puis évaporée ou que l'extraction s'est mal passée. Dans tous les cas notre rendu est très faible ; la récupération de ces substances est très élaborée.
Nous nous sommes donc posés la question suivante : cette huile peut-elle être transformée en biocarburant ? Et si oui, comment et par quel(s) moyen(s) ?